POUR DESINFECTER L'EAU DE SA PISCINE,
UN ELECTROLYSEUR DE SEL?
Le plaisir de se baigner dans une eau de piscine PROPRE et PURE. Parfaitement SAINE et SANS RISQUE pour votre santé. Mais aussi pour celle de la nature.
Ce qu'il faut savoir avant d'utiliser un électrolyseur de sel
Pour bien utiliser un électrolyseur de sel, il y a des connaissances de base à acquérir. Premièrement des fondamentaux au sujet de l'eau, et si vous décidez d'acquérir un électrolyseur, de faire un choix éclairé. Vous aurez ainsi la pleine satisfaction d'un achat utile et vous jouirez des agréments d'une eau claire, cristalline, de qualité, et pour longtemps.
L'eau stockée dans un bassin est incontestablement sujette à une contamination et à une dégradation liées à l'action du soleil, aux germes présents dans l'air et de ceux qui sont apportés par contact animal (insectes ou oiseaux par exemple) ou humains. Viennent ensuite les algues et les différents dépôts en bordure et en fond de bassin qui sont le résultat de l’eau impure.
Les piscines posent un problème particulier en ce qui concerne l'hygiène et la santé des utilisateurs. Les nageurs introduisent inconsciemment dans l'eau quantité de germes pathogènes et de moisissures (entre 1.000.000 à 1.000.000.000) plus des produits azotés, tels que des protéines et des acides aminés en provenance de la transpiration, de la salive, de l’urine, etc. A la faveur d'une température propice, de nombreux microorganismes peuvent se développer à grande vitesse ce qui intervient défavorablement sur la qualité de l’eau. Pour rester saine et claire, l'eau d'une piscine doit donc être traitée et désinfectée pour détruire les bactéries, les virus, les champignons, et stopper la prolifération des algues.

Le traitement physique est une étape indispensable de la désinfection de l’eau de piscine. Il consiste à éliminer les impuretés par des moyens physiques et/ou mécaniques. C’est pourquoi une piscine doit être équipée d'un système de filtration efficace, car un traitement physique performant résout 80% des problèmes de traitement d'eau.
La filtration a pour but d'éliminer les particules et les matières colloïdales en suspension qui sont à l'origine du trouble de l'eau. Les impuretés qui sont liées à la pollution aérienne (pollen, feuilles, insectes, ...) ou humaine (sueur, cheveux, ...) sont retenues par la masse filtrante (sable, diatomées ou cartouches). Cette filtration qui élimine une partie des matières organiques diminue la quantité de désinfectant à ajouter.
La technique de filtration est caractérisée par :
La coagulation: les fines particules présentes dans l’eau sont chargées d’électricité négative, elles se repoussent et restent donc séparées. Pour qu’elles puissent se rapprocher il faut les rendre électriquement neutres. On utilise pour cela des réactifs contenant des ions d’aluminium injectés près de la pompe de circulation.
La floculation: après la coagulation les particules sont agglomérées pour pouvoir être retenues par le filtre. Dans l’eau les ions d’aluminium vont réagir pour former de l’hydroxyde d’aluminium, précipité volumineux appelé « floc ». Ce phénomène fait intervenir des ions bicarbonates. C’est la raison pour laquelle le TAC doit être supérieur à 10°F. La réaction libère du gaz carbonique qui abaissera légèrement le pH. De plus le «floc» se forme dans une zone de pH bien déterminée, au-delà de 7,5 à 7,6 la précipitation n’est plus totale et on gaspille une partie du floculant.
Le filtre: on distingue essentiellement deux familles de filtres : les filtres à diatomite et les filtres à sables
(sable que l'on remplace par du verre). La matière filtrante utilisée détermine la nécessité d’injecter des floculants : l’injection de floculant est proscrite dans le cas des filtres à diatomite ou zéolite.
Ne pas faire floculer un filtre à diatomées (colmatage assuré), Réservé au filtre à sable
Temps de filtration:Afin de connaître le nombre d'heures de filtration nécessaires, l’expérience autorise l’application d’une formule empirique qui consiste à diviser par 2 la température de l'eau pour calculer le nombre d'heures de filtration. Ainsi, pour une eau à 26°C, le temps de filtration nécessaire est de 13 heures par jour. Il est généralement recommandé de faire fonctionner la filtration pendant les heures d'utilisation de la piscine. Pour obtenir une eau de qualité optimale, il est impératif d'atteindre un débit de filtration minimum mais aussi de rajouter de 30 à 100 litres d'eau par baigneur et par jour lorsqu’il fait chaud.
L'eau de pluie traverse les couches du sol et du sous-sol et se charge en sels minéraux , en matières organiques et en sels dissous. On retrouve ces composants dans les eaux de piscines provenant du réseau d'eau de ville à laquelle s'ajoutent ceux provenant de l'usage de la piscine et des produits de traitement.
Que rencontre-t-on dans une piscine ?
-
Des sels minéraux comme:
- Le calcium Ca++ et le magnésium Mg++ déterminent la dureté de l'eau (titre hydrotimétrique TH).
- Les carbonates CO 3- et les bicarbonates HCO3 déterminent l'alcalinité de l'eau (titre alcalimétrique complet TAC)
- Les chlorures CI- et les bromures Br- qui proviennent essentiellement de l'action du désinfectant utilisé et leur concentration caractérise le "vieillissement" de l'eau.
-
Des matières organiques:
- L'essentiel des matières organiques présentes dans l'eau sont amenées par les baigneurs.
- Des gaz dissouts.
- Les chlorures CI- et les bromures Br- qui proviennent essentiellement de l'action du désinfectant utilisé et leur concentration caractérise le "vieillissement" de l'eau. Les principaux gaz dissous sont l'oxygène 02 et le gaz carbonique CO 2 qui influent sur l'équilibre calco-carbonique de l'eau.
Cet équilibre tourne autour de 3 axes que sont sa dureté, son alcanilité et son pH. L'équilibre de l'eau est prépondérant. De cet équilibre dépend la réussite de l'excellence de la qualité de l'eau de la piscine mais aussi la durée de vie et l'efficacité de vos installations.
Une eau entartrante dépose du carbonate de calcium dans le sable des filtres et gêne leur fonctionnement, dans les canalisations et réduit leur débit, sur les parois du bassin où s'incrustent des micro-organismes, sur les vannes dont le maniement devient difficile. Une eau agressive, quant à elle, corrode les canalisations et parties métalliques et attaque les joints de carrelage des bassins. II faut donc, en fonction d'un TH connu et d'un pH souhaité, déterminer le TAC d'équilibre de l'eau, ou, connaissant le TAC et le TH, déterminer le pH d'équilibre.
Dureté de l'eau
La dureté de l'eau est représentée par son TH (Titre Hydrotimétrique), exprimé en degrés français (°f), est fonction de la concentration en sels de calcium et de magnésium. Dans une eau de piscine le TH idéal se situe entre 10 et 20° F. Au delà de 30°F il est souhaitable d’installer un adoucisseur d’eau. En dessous, il faut augmenter le TH. Une eau douce possède un TH compris entre 0 et 10°f, une eau dure au delà de 35°f. Un test qualitatif simple pour évaluer le titre hydrométrique consiste à se savonner les mains. Si on a des difficultés à éliminer le savon par rinçage, l’eau est douce. Si le savon ne mousse pas ou peu, l’eau est dure.
Une eau trop douce aura tendance à être agressive et à entraîner de la corrosion au niveau des parties métalliques (filtres, pompes, filtrations)0. Par contre une eau dure provoquera un entartrage des tuyauteries.
Alcalinité de l'eau
L'alcalinité de l'eau est représentée par son TAC (Titre Alcalimétrique complet), exprimé en degrés français (°f), est fonction de la concentration en ions carbonates (CO3) et bicarbonates (HCO3). L’eau de pluie est acide car elle dissout du gaz carbonique (CO2) ainsi que l’acide sulfurique (H2SO4) et de l’acide nitrique (HNO3) provenant tous deux de la pollution atmosphérique. En traversant les roches calcaires elle dissout du carbonate. En général l’eau de piscine contient surtout des bicarbonates compte tenu de son pH et on assimile donc le TAC à la teneur de ces derniers. Le TAC caractérise le pouvoir tampon de l'eau, c'est à dire la capacité d'influence d'un produit acide ou basique sur le pH de l'eau. Plus le TAC est élevé, et plus il est difficile de faire varier le pH de l'eau. Le pH, TH et TAC sont directement liés par plusieurs relations qui permettent de définir pour un pH donné, les valeurs optimales du TH et du TAC. Le tout est représenté sous la forme d’un diagramme appelé balance de Taylor. Note : sur le diagramme ci-dessous 200ppm correspondent à 20°F
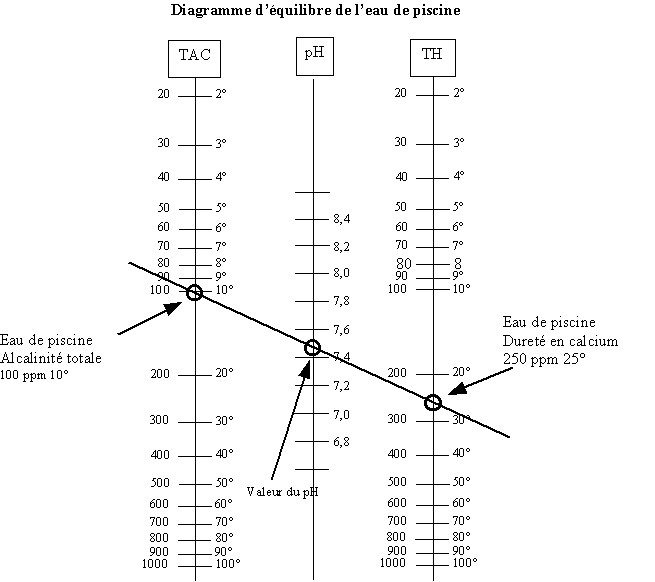
Le pH, le TAC et le TH sont étroitement liés. Il existe plusieurs relations et diagrammes permettant de définir pour un pH d’équilibre donné (pHe) les valeurs optimales du TAC et du TH, que l’on peut simplifier par les relations suivantes :
- TH x TAC = 400 à pHe = 7,2
- TH x TAC = 300 à pHe = 7,3
- TH x TAC = 200 à pHe = 7,5
On admet une marge de ± 0.3 avant que l’eau ne devienne franchement agressive ou entartrante. Il n’y aura aucun inconvénient à maintenir le pH entre 7,2 et 7,8. Cependant, si vous souhaitez vous baignez dans les meilleures conditions possibles et optimisez un système au sel, il est très souhaitable de vous rapprocher d'un pH d'environ 7,2.
Le pH ou potentiel hydrogène
Le pH ou potentiel hydrogène est directement lié à l'équilibre de dissociation de l'eau :
H20 <=> H+ + OH- avec [H+] x [OH-] = 10-14
L’ion H+ amène l’acidité, l’ion H- la basicité
Une eau pure, où la quantité d'ions H+ est égale à celle des ions OH-, sera donc caractérisée par un pH de 7, appelé neutre. Une eau naturelle aura un pH en fonction de la nature et de la quantité des sels dissous.
Gamme de pH à respecter en piscine
Une eau de piscine doit avoir son pH neutre ou très légèrement basique (de 6,9 à 7,7 d'après la réglementation).
L’efficacité maximale des désinfectants est lorsque l’eau a un pH compris entre 7,1 et 7,4. Maintenu à cette valeur,
la quantité de désinfectant nécessaire à l’entretien sera réduit considérablement. Pour exemple : à un pH de 7,0,
la quantité de chlore libre est de 70%, alors qu'elle est de 20% à un pH de 8,0.
Le pH idéal étant celui qui est le plus proche possible du pH moyen du liquide lacrymal situé vers 7,4.
Le liquide lacrymal est le désinfectant naturel de l'oeil, constituant les larmes. Il est très important de bien maîtriser
ce paramètre car il a un effet très important sur :
- l'activité des désinfectants
- l'irritation des yeux et de la peau
- la corrosion des installations métalliques
- l'activité des floculants (sulfate d'alumine...)
- la précipitation des sels de calcium qui provoque l'entartrage des canalisations
- le développement des algues
Quelques régulateurs pH pour faciliter
Variation du pH en fonction des paramètres (température, revêtement, fréquentation, désinfectant ...)
Plusieurs paramètres vont influencer la tenue dans le temps du pH d'une eau de piscine :
- la nature du produit désinfectant
- les hypochlorites (extrait de javel, hypochlorite de calcium) provoquent une importante augmentation du pH
- Cl2 (chlore gazeux) et Br2 (brome liquide) provoquent une diminution du pH
- DCCNa (dichloroisocyanurate de sodium GR 63) n'influe pas le pH
- ATCC (acide trichloroisocyanuriquc 90/200) provoque une lucre diminution du pH
- L’ajout de floculant va entraîner une légère diminution du pH
- La nature du revêtement. Le ciment provoque une augmentation du pH pendant une durée de 4 mois environ
- La hausse de la température, l’agitation de l’eau, la présence d’algues, provoquent un départ de CO2 et donc une hausse du pH
- Dégazage du gaz carbonique par agitation (jeux aquatiques)
- Influence des réactifs (coagulation, floculation, désinfectant)
- Dissolution du ciment ou des mortiers (joints de carrelage par exemple).

